Condições
Quando se precisa de acesso direto ao essencial
Cardiopatia Hipertrófica: estratificação de risco
Introdução
A Cardiopatia Hipertrófica (CH) é a doença genética cardíaca mais comum. Sua incidência é estimada em 1:500 nascidos. É caracterizada por hipertrofia (espessura ≥15mm para diagnóstico) na ausência de outra condição cardíaca ou sistêmica que a justifique (p.ex. HAS, estenose aórtica, atleta, etc).
É causada por grupo de mutações em genes responsáveis por proteínas do sarcômero. Possui expressão clínica heterogênea: desde o assintomático até manifestações como intolerância ao esforço, dor torácica, síncope, insuficiência cardíaca, AVC tromboembólico e morte súbita. Em 30% dos casos, não apresenta obstrução de via de saída. Não há predileção por sexo, apesar de as mulheres apresentarem maior tendência à insuficiência cardíaca.
Trata-se de traço autossômico dominante com lista extensa de mutações. Sua variedade de manifestações é explicada por:
• Tipo de mutação
• Presença de genes modificadores
• Fatores ambientais
Há doenças de apresentação semelhante no que se refere à hipertrofia, mas com mecanismos distintos: doença de Fabry, mutação PRKAG2 e LAMP2( doença de Danon).
Sintomas
Além dos pacientes assintomáticos, há várias possibilidades de queixas:
• Dispnéia de esforço
• Dor torácica típica ou atípica
• Sintomas francos de ICC (ortopnéia e dispneia paroxística noturna) em casos avançados
• Palpitações (por ectopias atriais ou ventriculares ou mesmo por fibrilação atrial)
• Síncope ou pré-síncope (relacionadas com arritmias ou obstrução de via de saída)
Exame físico
O exame é variável e depende do estado hemodinâmico no momento da avaliação. Existem vários achados possíveis:
• Normal (em grande quantidade dos pacientes)
• Sopro sistólico de ejeção em bordo esternal esquerdo inferior e ápice (quando há obstrução)
• Presença de B3 ou de B4
• Sopro de insuficiência mitral
• Ritmo cardíaco irregular (quando em fibrilação atrial)
Eletrocardiograma
Em 90% dos pacientes haverá ECG alterado. Em avaliações familiares há ECG anormal em 75% dos parentes assintomáticos. Não existe padrão típico. Os achados mais comuns são:
• Sinais de hipertrofia ventricular esquerda
• Inversão de onda T em derivações precordiais laterais
• Sobrecarga de átrio esquerdo
• Onda Q profunda e onda R diminuída em derivações precordiais lateraisl
Morfologia
As características morfológicas da CH são importantes, pois o diagnóstico é geralmente feito através do ecocardiograma e, eventualmente, através da ressonância magnética. A ressonância pode ser indicada quando há janela acústica desfavorável, ecocardiograma duvidoso, na hipertrofia segmentar anterolateral e nas alterações do ápice do VE (hipertrofia apical e aneurisma).
Não existe padrão clássico para a CH. Tipicamente, uma ou mais regiões do ventrículo esquerdo (VE) tem espessura maior que as outras. Pode haver extensão para o ventrículo direito (VD).
Mesmo entre irmãos (que não sejam gêmeos idênticos) pode haver padrões distintos. Frequentemente (até 50%) a hipertrofia é difusa. Em uma minoria, há apenas áreas segmentares acometidas.
Holter
Arritmias ventriculares são achados comuns na CH, estando presentes em até 90% dos pacientes. Nas avaliações de holter 24h, são encontrados:
• ?200 ectopias em 24h em >20%
• Pares em >40%
• TVNS em 20-30%
• 10% dos pacientes apresentarão ?200 ESV em 24, ?5 Pares e ?1 TVNS
Tratamento
1) Fármacos
• São indicados para alívio dos sintomas de intolerância ao esforço e da dor torácica
• Os betabloqueadores (propranolol, atenolol, metoprolol e nadolol) são utilizados com intuito de diminuir contratilidade e frequência cardíaca e assim promover queda do gradiente de via de saída, queda do consumo de oxigênio e aumento do enchimento do VE
• Os bloqueadores de cálcio (verapamil e diltiazem) têm a função de melhorar o relaxamento ventricular e, assim, melhorar o enchimento. Cuidado com uso quando obstrução grave de via de saída de VE (GS máx ?100mmHg) ou hipertensão pulmonar
• A disopiramida associada ao betabloqueador pode ser útil naqueles pacientes ainda sintomáticos após bloqueio adrenérgico
• Eventualmente, pode-se lançar a mão de combinação de betabloqueador com bloqueador de cálcio em pacientes refratários. Cuidado com o desenvolvimento de bradicardia
• O uso de anticoagulantes orais deve ser fortemente considerado em portadores da associação CH e fibrilação atrial devido ao risco de eventos tromboembólicos
• Naqueles pacientes com disfunção sistólica, o tratamento é similar ao dos portadores de insuficiência cardíaca congestiva de outras etiologias
2) Miectomia
• Geralmente indicada em pacientes com gradiente ?50mmHg e que mantém classe funcional III e IV apesar do máximo esforço farmacológico
• Altera o curso da doença com impacto favorável na expectativa de vida, aproximando da curva dos não portadores de CH
3) Ablação septal alcoólica
• Alternativa à miectomia quando paciente de alto risco para cirurgia
• Resultado inferior ao do procedimento cirúrgico, por vezes com necessidade de repetição
• Risco de eventos taquiarrítmicos causados pela formação de cicatriz e risco de bloqueio atrioventricular com necessidade de implante de marca-passo definitivo
• Alguns serviços indicam implante profilático de CDI em pacientes submetidos à ablação septal
4) Marca-passo
• Objeto passado de grande interesse pela promessa de diminuir gradiente de via de saída de VE através de dissincronismo ventricular induzido pela estimulação de ponta de VD
• Estudos demonstram resultado muito mais subjetivo do que mensurável, indicando provável efeito placebo
• Alguns grupos de pacientes idosos parecem se beneficiar do procedimento
• Eventualmente indicando em pacientes que possuem contra-indicação para miectomia ou ablação septal
5) Desfibriladores (ver sessão sobre morte súbita)
Morte súbita
Registros de pacientes portadores de CDI demonstram que o desenvolvimento de arritmas ventriculares complexas (taquicardias ventriculares rápidas ou fibrilação ventricular) são, geralmente, a via final do mecanismo de morte súbita (MS) nos portadores de cardiopatia hipertrófica.
Há estudo correlacionando o início de taquicardia ventricular monomórfica com a presença de fibrilação atrial ou taquicardia sinusal sugerindo, deste modo, que o desenvolvimento de arritmias ventriculares pode estar ligado, em alguns casos, à presença de atividade adrenérgica aumentada.
O substrato para desenvolvimento de eventos arrítmicos na cardiopatia hipertrófica parece estar ligado ao desarranjo estrutural miocárdico (fibras musculares perpendiculares ou oblíquas e isquemia por arteríolas anormais levando à fibrose).
O uso de drogas não promove proteção contra morte súbita na cardiopatia hipertrófica. Os fármacos classicamente recomendados como betabloqueadores, bloqueadores de cálcio ou disopiramida têm papel na redução dos sintomas.
O uso de amiodarona igualmente não fornece proteção plena contra eventos arrítmicos complexos, fato que pode ser comprovado em pacientes portadores de CDI e que continuam a apresentar taquiarritmias ventriculares com necessidade de terapia apesar do uso continuado da droga.
O CDI tem papel fundamental como profilaxia secundária da morte súbita, onde há registro de necessidade de terapia pelo CDI em mais de 40% dos pacientes em curto período de tempo levando à incidência de 11% de eventos ao ano.
Nos pacientes que recebem implante como profilaxia primária, há uma incidência de terapia relatada em 4% ao ano. Isto se correlaciona com números da era pré-CDI, onda havia registro de 4-5% de incidência de MS em pacientes de alto risco.
Os problemas relacionados ao implante de dispositivo estão ligados à idade jovem dos pacientes que o recebem (idade média de 40 anos), pois os doentes são expostos por mais tempo à possibilidade de choques inapropriados, fratura de eletrodo, infecções e outros.
Até o momento, o implante de desfibrilador é a única medida com real capacidade de mudança do prognóstico dos pacientes definidos como de alto risco para MS.
Estratificação de Risco
Um dos grandes desafios na Cardiomiopatia Hipertrófica (CH) é a identificação daqueles doentes com risco aumentado de morte súbita(MS). Não há dificuldade em indicar implante de CDI como profilaxia secundária de MS (evento prévio de morte súbita abortada ou taquicardia ventricular sustentada) devido ao grande risco de recorrência de eventos (11% ao ano). O problema encontra-se em indicar os melhores candidatos para profilaxia primária.
São fatores de risco conhecidos para MS:
1) História familiar de morte súbita precoce relacionada à cardiopatia hipertrófica em parente de primeiro grau ou de múltiplas ocorrências
2) Síncope sem causa definida (ou comprovadamente arrítmica), particularmente em paciente jovem
3) Hipertrofia importante (30mm ou mais), especialmente em paciente jovem
4) TV não sustentada
5) Resposta de pressão anormal ao teste ergométrico (hipotensiva ou atenuada)
Os fatores de risco têm poder razoável para identificar os pacientes sob maior probabilidade de evento súbito até por volta dos 50 anos de idade, pois as chances de eventos arrítmicos diminuem de acordo com o avançar da faixa etária. Estatísticas demonstram baixa taxa de eventos em pessoas acima de 60 anos com a doença (0.2% ao ano).
Até recentemente, a presença de apenas um dos fatores acima era considerada suficiente para sugerir a necessidade de implante profilático de CDI. No entanto, mais recentemente, a presença de TV não sustentada e de resposta anormal de pressão durante o teste ergométrico passaram a não ser mais suficientes (quando presentes isoladamente) para indicar a necessidade de profilaxia.
É importante ressaltar que mesmo nos pacientes sem fatores de risco clássicos, existe mortalidade súbita ligada à doença de 0.5% ao ano.
Existem diretrizes específicas sobre cuidados com portadores de CH publicadas em anos recentes.
2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy
A publicação revela dados como:
Mortalidade por CH 1-2% ao ano
Principais mecanismos: morte súbita, insuficiência cardíaca e tromboembolismo arterial são os
MS: geralmente por fibrilação ventricular. Bloqueio atrioventricular e atividade elétrica sem pulso são descritos.
Avaliação do risco: história, Holter 48h, ECO (RM se janela ruim) e TE.
Os autores fazem comentários sobre a avaliação de risco, ressaltando a ausência de estudos randomizados ou validados estatisticamente (recomendações baseadas em estudos observacionais).
Em seguida, criticam a Diretriz Americana sobre cardiomiopatia hipertrófica de 2011 ao tratar variável espessura como binária quando é associada com aumento contínuo do risco e aofalar sob avaliação de fibrose através de RM, aneurismas e mutação como fatores menores, mas sem dados suficientes para dar suporte.
Consideram modelo americano como de poder moderado para discriminar entre baixo e alto risco.
Posteriormente descrevem o modelo da Sociedade Europeia de Cardiologia (ESC) como resulltado de estudo longitudinal envolvendo 3675 pacientes, que excluiu resposta anormal de pressão ao esforço e que estima risco de MS em 5 anos.
Modelo da ESC utiliza fórmula complexa que envolve:
1) Máxima espessura ventricular
2) Presença de morte súbita familiar
3) TVNS
4) Síncope inexplicada
5) Diâmetro de AE
6) Gradiente de via de saída
7) Idade atual
Pacientes são classificados em três categorias de risco de MS em 5 anos:
1) Baixo: <4% (CDI geralmente não indicado)
2) Intermediário: ?4% e <6% (CDI pode ser indicado)
3) Alto: ?6% (CDI deve ser considerado)
Quando modelo não deve ser utilizado:
1) Pacientes <16 anos
2) Atletas de elite
3) Doenças metabólicas/infiltrativas(Anderson-Fabry p.ex.) e síndromes como Noonan

Autores comentam que modelo não é validado após miectomia ou ablação septal alcoólica, ressaltam que nos casos de baixo risco pelo modelo, o CDI por ser indicado em pacientes jovens com múltiplos eventos de MS na família ou em caso de resposta de pressão anormal ao exercício (nestas situações, a decisão dever ser individualizada).
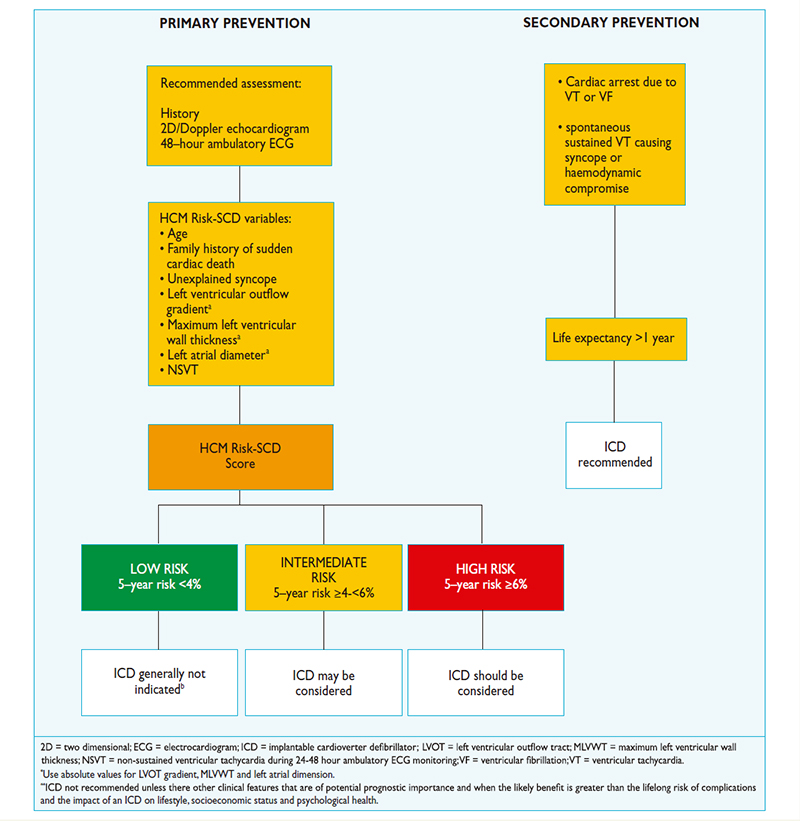
European Heart Journal (2014) 35, 2733?2779
Finalmente são feitos comentários sobre estratificação da CH em crianças:
1) Poucos dados em menores de 8 anos
2) Aceitação de fatores como: hipertrofia grave, síncope, TVNS e MS familiar
3) Sugerem implante quando 2 ou mais fatores
4) Sugerem avaliação cuidadosa quando apenas 1 fator presente

European Heart Journal (2014) 35, 2733?2779
2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy
Autores citam que uma minoria dos pacientes com CH tem risco aumentado de MS, e que CDI é a única medida preventiva atual. Reforçam a dificuldade para selecionar doentes para profilaxia primária em comparação à decisão de implante para profilaxia secundária.
Comentam sobre fatores de risco estabelecidos:
1) História familiar: alguns estudos ligam HF de MS ao maior risco para os familiares portadores de CH. Outros estudos não demonstram esta ligação. Acreditam que pode ser explicado pela baixa incidência de eventos nos estudos e pela definição não uniforme de morte súbita familiar ligada à doença.
2) Síncope: tem importância quando se trata de síncope inexplicável ou de evento claramente arrítmico. Há ligação com risco de MS quando síncope ocorreu há menos de 6 meses, o que deixa de ocorrer com episódios relatados há mais de 5 anos.
3) Taquicardia Ventricular Não Sustentada (TVNS): fator de risco com dados menos robustos. Apenas 1 de 5 estudos citados demonstrou associação com MS em análise univariada e 1 estudo recente com associação em análise multivariada. Tem maior importância quando ocorre em pacientes jovens (idade <30 anos). Não há dados que ressaltem número ou duração dos eventos como critérios de impacto.
4) Espessura da parede: há uma relação linear entre a espessura máxima da parede ventricular e o risco de MS. Valores maiores ou iguais a 30mm têm maior risco, especialmente em pacientes jovens.
5) Resposta anormal da PA durante exercício: em até 1/3 dos pacientes, pode haver resposta anormal da pressão durante o teste ergométrico (falha em aumentar em 20mmHg a pressão sistólica ou até mesmo queda superior a 20mmHg). Dois estudos demonstraram associação com risco de MS em análise univariada.
Fazem referência aos potenciais modificadores de risco:
1) Obstrução de Via de Saída de VE: alguns estudos relacionam gradiente de via de saída de VE ?30mmHg em repouso ao risco de MS.
2) Realce Tardio com Gadolínio: a presença de realce tardio na Ressonância Magnética é, provavelmente, devido à ocorrência de fibrose. A consequência disso é a formação de cicatrizes e, deste modo, forma-se a propensão à arritmia por reentrada. Trata-se de dado com baixo valor preditivo positivo.
3) Aneurisma Apical de VE: por volta de 2% dos pacientes apresentam aneurisma de ponta de VE. Estes são mais propensos ao desenvolvimento de insuficiência cardíaca e, provavelmente devido à ocorrência de fibrose local, parecem estar mais sujeitos à ocorrência de arritmias ventriculares. Os dados a respeito ainda são limitados.
4) Mutações Genéticas: alguns padrões de mutações genéticas foram implicados como de características ?malignas? com relação à ocorrência de arritmias ventriculares graves. No entanto, estudos posteriores questionaram esta possibilidade de inferência. Atualmente, o estudo genético de rotina para fins de estratificação de risco ainda não tem valor definitivo.

JACC Vol. 58, No. 25, 2011: e212?60
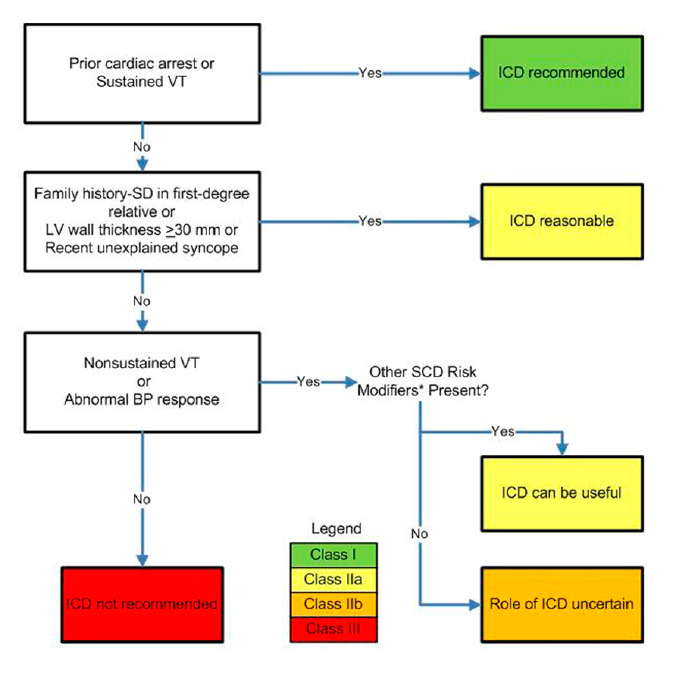
JACC Vol. 58, No. 25, 2011: e212?60
Figuras
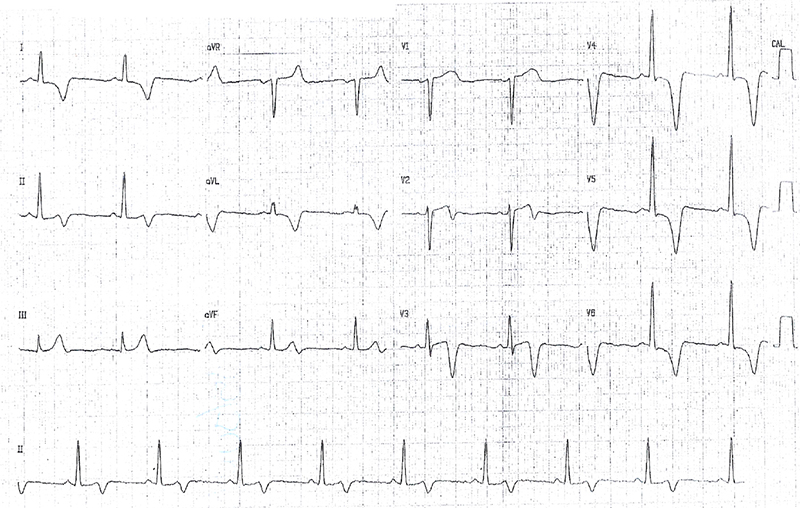
Paciente masculino de 41 anos de idade. Queixa de dor torácica. Exame físico normal. Ecocardiograma com HVE simétrica com espessura de 14mm. Ressonância magnética com hipertrofia predominante de ápice do VE (16mm). Avaliação familiar: irmão com morte súbita aos 38 anos durante o sono. Duas filhas do paciente com alterações eletrocardiográficas e ecocardiogramas compatíveis com CH.
